Les parties codantes sont appelées exons, les séquences non codantes sont appelées introns. L'information d'un gène est donc fragmentée et doit donc être assemblée lors de l'expression du gène. Pour ce faire, une copie d'ARN du gène est d'abord produite comme précurseur, le pré-ARNm (ARNm précurseur). Les introns de ce pré-ARNm sont ensuite reconnus et découpés par une énorme machine moléculaire, le spliceosome. Ce processus est appelé épissage. Après l'épissage et d'autres processus de maturation, l'ARNm "mature" est formé.
A première vue, la fragmentation des gènes semble compliquée et pose à la cellule le défi d'identifier et d'éliminer sans erreur les parties non codantes. Pourquoi cette architecture étrange a-t-elle été favorisée par l'évolution ?
La structure modulaire des gènes offre l'avantage que les sections porteuses d'information peuvent être combinées de différentes manières. Ce processus est également appelé épissage alternatif. Par exemple, les humains peuvent produire plus de 100 000 produits génétiques différents à partir d'environ 22 000 gènes. Comme l'épissage alternatif est plus courant chez les organismes plus complexes, on se demande si ce mécanisme a joué un rôle central dans le développement des organismes supérieurs.
Un exon entre la vie et la mort
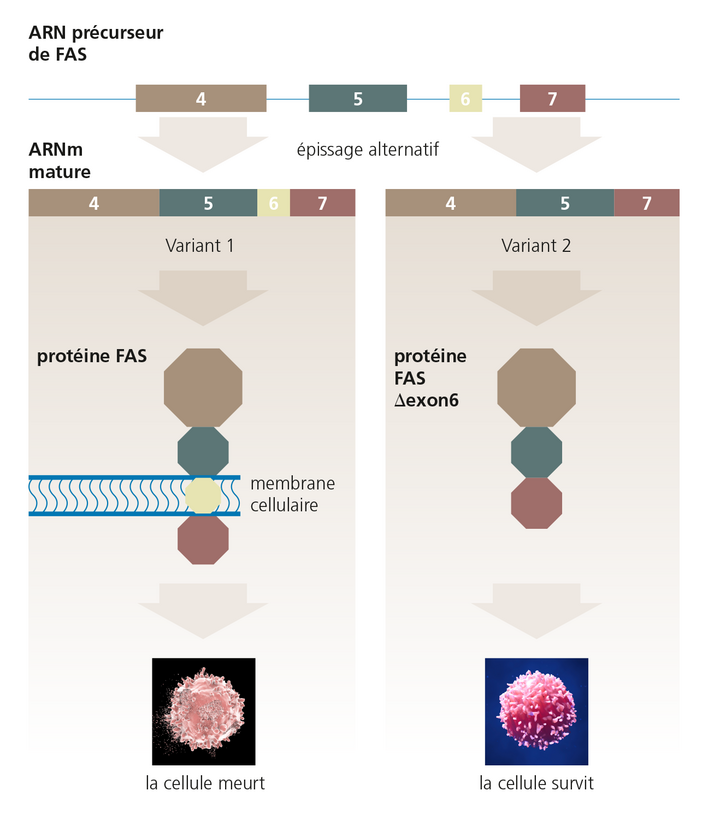
Même de petites différences dans l'épissage de l’ARNm d'un gène peuvent avoir des effets dramatiques. Dans l'exemple montré ici, la présence ou l'absence de l'exon 6 dans l'ARNm mature du gène FAS détermine si la protéine produite favorise la survie cellulaire ou, au contraire, entraîne sa mort. Cette forme strictement réglementée de mort cellulaire est destinée dans certaines situations et sert le bien-être de l'organisme. On a découvert très tôt que les mutations qui influencent l'épissage des gènes sont responsables de maladies. La fibrose kystique, l'atrophie musculaire spinale, la dystrophie musculaire de Duchenne et divers cancers en sont des exemples.