Le SARS-CoV-2 dépend de façon critique d'un mécanisme particulier pour la production de ses protéines. Une équipe collaborative dirigée par un groupe de recherche de l'ETH Zurich a obtenu des informations moléculaires sur ce processus et a démontré qu'il pouvait être inhibé par des composés chimiques, réduisant ainsi de manière significative la réplication virale dans les cellules infectées.
Vidéo : Said Sannuga, Cellscape.co.uk / ETH Zurich, The Ban Lab
Les virus ont besoin des ressources d'une cellule infectée pour se répliquer, puis infecter d'autres cellules et se transmettre à d'autres individus. Une étape essentielle du cycle de vie viral est la production de nouvelles protéines virales sur la base des instructions contenues dans le génome ARN viral. Sur la base de ces plans de construction, la propre machine de synthèse des protéines de la cellule, appelée ribosome, produit les protéines virales.
En l'absence d'infection virale, le ribosome se déplace le long de l'ARN selon des étapes strictement définies, lisant trois lettres d'ARN à la fois. Ce code de trois lettres définit l'acide aminé correspondant qui est attaché à la protéine en croissance. Il n'arrive presque jamais que le ribosome glisse une ou deux lettres d'ARN en avant ou en arrière au lieu de suivre les étapes régulières de trois lettres. Lorsqu'un tel glissement du ribosome se produit, on parle de «décalage du cadre», ce qui entraîne une lecture incorrecte du code génétique.
Le décalage du cadre de lecture ne se produit presque jamais dans nos cellules. Cependant, certains virus, comme les coronavirus et le VIH, dépendent d'un changement de cadre pour réguler les niveaux de protéines virales. Par exemple, le SARS-CoV-2 - le virus responsable du COVID-19 - dépend de façon critique du changement de cadre de lecture favorisé par un pli inhabituel et complexe de l'ARN viral.
Par conséquent, étant donné que le changement de cadre est essentiel pour le virus mais qu'il ne se produit presque jamais dans notre organisme, tout composé qui inhibe le changement de cadre en ciblant ce pli de l'ARN pourrait potentiellement être utile comme médicament pour combattre l'infection. Cependant, jusqu'à présent, il n'existe aucune information sur la façon dont l'ARN viral interagit avec le ribosome pour promouvoir le changement de cadre, ce qui serait important pour le développement de médicaments.
Image détaillée d'un processus essentiel pour la réplication des coronavirus
Une équipe de chercheurs de l'ETH Zurich et des Universités de Berne, Lausanne et Cork (en Irlande) a réussi pour la première fois à mettre en évidence les interactions entre le génome viral et le ribosome lors du changement de cadre. Leurs résultats viennent d'être publiés dans la revue Science.
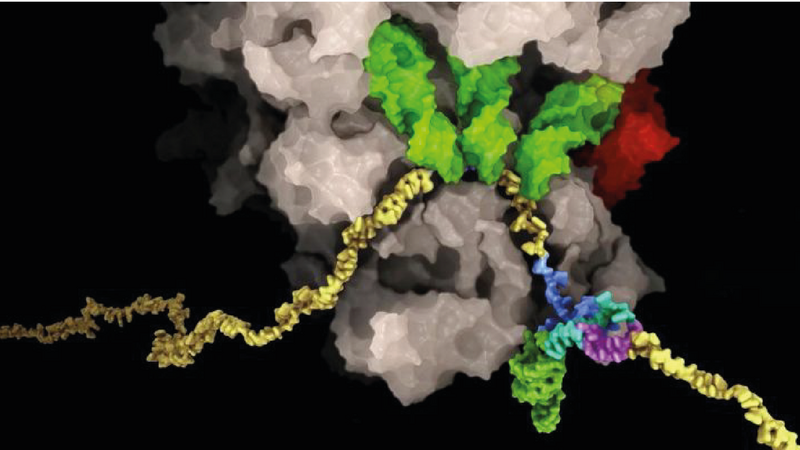
Grâce à des expériences biochimiques sophistiquées, les scientifiques ont réussi à capturer le ribosome au niveau du site de changement de cadre du génome ARN du SARS-CoV-2. Ils ont ensuite pu étudier ce complexe moléculaire à l'aide de la microscopie cryo-électronique.
Les résultats ont fourni une description moléculaire du processus avec un niveau de détail sans précédent et ont révélé un certain nombre de nouvelles caractéristiques inattendues. Le changement de cadre fait que la machine ribosomique, habituellement dynamique, adopte une conformation tendue, ce qui a permis de fournir l'une des images les plus nettes et les plus précises d'un ribosome de mammifère, visualisé dans le processus de changement de cadre lors de la lecture des informations du génome viral. Les scientifiques ont ensuite poursuivi leurs découvertes structurelles par des expériences in vitro et in vivo, notamment en explorant comment ce processus peut être ciblé par des composés chimiques. Nenad Ban, professeur de biologie moléculaire à l'ETH Zurich et co-auteur de l'étude, souligne que «les résultats présentés ici sur le SARS-CoV-2 seront également utiles pour comprendre les mécanismes de changement de cadre dans d'autres virus à ARN».
Cible possible pour le développement de médicaments antiviraux
La dépendance du coronavirus à l'égard du déplacement du cadre de lecture pourrait être exploitée pour le développement d'agents antiviraux. Des études antérieures ont indiqué que plusieurs composés chimiques peuvent supprimer le déplacement des cadres dans d'autres coronavirus. Cependant, cette étude est la première à fournir des informations sur la manière dont ces composés affectent la concentration du SARS-CoV-2 dans les cellules infectées.
Dans les expériences, les deux composés ont réduit la réplication virale de mille à dix mille fois. De plus, les substances utilisées n'étaient pas toxiques pour les cellules traitées. Cependant, seul l'un des deux semble réduire la réplication virale en inhibant le déplacement des cadres ribosomiques, tandis que l'autre agit probablement par un mécanisme différent.
Bien que ces composés ne soient actuellement pas assez puissants pour être utilisés comme médicaments thérapeutiques, cette étude démontre que l'inhibition du déplacement du cadre ribosomal a un effet profond sur la réplication virale, ce qui ouvre la voie au développement de meilleurs composés. Étant donné que tous les coronavirus dépendent de ce mécanisme conservé de changement de cadre, un médicament ciblant ce processus pourrait même être utile pour traiter les infections causées par des coronavirus plus éloignés. «Nos futurs travaux se concentreront sur la compréhension des mécanismes de défense cellulaire qui suppriment le changement de cadre viral, car cela pourrait être utile pour le développement de petits composés ayant une activité similaire», explique Nenad Ban.
Détails de la publication
Pramod R. Bhatt, Alain Scaiola, Gary Loughran, Marc Leibundgut, Annika Kratzel, Romane Meurs, René Dreos, Kate M. O'Connor, Angus McMillan, Jeffrey W. Bode, Volker Thiel, David Gatfiled, John F. Atkins, Nenad Ban: Structural basis of ribosomal frameshifting during translation of the SARS-CoV-2 RNA genome. Science; published online 13 May 2021
https://science.sciencemag.org/content/early/2021/05/12/science.abf3546